発達障がい市民広場

- ホーム
- (一般の方へ)発達障がい市民広場
- 最新医学論文36
第36号
最新医学論文36
CD38とCD157:活性化マーカーから多機能分子への長い旅
CD38 and CD157: A long journey from activation markers to multifunctional molecules
Quarona V, Zaccarello G, Chillemi A, Brunetti E, Singh VK, Ferrero E, Funaro A, Horenstein AL, Malavasi F.
Cytometry B Clin Cytom. 2013 Apr 10.
CD38(T10としても知られる)は1970年代後半に、Dana-Farber Cancer Center(Boston, MA)で行われた先駆的研究の中で同定された。そこでは、抗原認識に関連する表面分子の同定に焦点が当てられていた。CD38は当初、胸腺とTリンパ球で発見された。しかし現在では、発現レベルは様々ではあるが、その分子が免疫系全体を通して見られることが知られている。そのため、CD38は「活性化マーカー」と考えられ、この用語はフローサイトメトリーでは未だにポピュラーである。このレビューは、様々なアプローチから得られた発見を要約し、それによりCD38を多機能分子として再定義する。CD38とそのホモログであるCD157(BST-1)はヒト染色体4(4p15)上で連続的な遺伝子重複であり、双方向性のシグナルによって細胞の社会的生命を調節する産生物をコード化する遺伝子ファミリーの一部である。CD38とCD157はともに、レセプターと表面酵素として二重の役割を果たし、シグナル伝達と細胞のホメオスターシスに関連する複雑な活動に寄与している。ここで示される構造-機能分析は、臨床科学者とフローサイトメトリストにこれらの分子の背景的知識を与えることを目的としている。CD38/CD157とヒトの疾患との関係は、他の疾患との関連も知られてはいるが、ここでは慢性リンパ性白血病、ミエローマ(骨髄腫)と卵巣癌について述べる。かくしてCD38とCD157は単なる白血球活性マーカーからヒトの健康と疾患に関わる多機能分子へと進化してきた。今後の課題は、in vivoでの治療的介入のターゲットとして、また免疫応答の調節因子としてのそれらの可能性を探ることである。
CD38遺伝子ファミリー
CD38とCD157はヒト染色体4番(4p15)上に位置する。70kbのCD38遺伝子の98%以上はイントロン配列で表されている。8つのエクソンを含み、最も大きいエクソン1は細胞質内、膜貫通領域、細胞外領域の33の膜近位アミノ酸を決定している。CD38の発現は極めて複雑な多層転写制御下にあるように思われる。制御の第一層はTATAボックス(*1)の欠如とCpGアイランド(*2)の存在によって特徴づけられるプロモーター領域にあり、メチレーション制御領域は組織特異的な遺伝子よりもハウスキーピングに関連づけられる。制御の第二層はCpGアイランドの上流にあると思われ、そこは転写因子(e.g. T細胞転写因子1、インターロイキン6の核因子)に対する候補結合サイトであり、一方遺伝子制御の第3レベルはCD38遺伝子の最初のイントロン内にある。イントロン1の5’末端はレチノイン酸とペルオキシソーム増殖因子活性化受容体γ(PPAγ)の反応要素を含んでいる。イントロン1はまた、転写因子E2Aに結合する一塩基多型(SNP)の位置でもあり、そのバリアントは病理学において様々に表されている(下記参照)。
CD157遺伝子は35kb以上にわたって伸びており、そのパラログ(*3)であるCD38と非常に近く、9つのエクソンからなる。CD38とCD157は高度に保存されており、エクソン2-8は長さが同様でイントロン挿入の同位相を維持しているという事実によって実証される。ヒトCD157遺伝子の5’隣接領域はインターフェロン応答エレメント(γ-IREs、ISRE様)と核転写因子(E2A、AP2、AP3、PEA3、C/EBP、CREB、Sp1)、サイトカイン応答因子(NF-IL-6、NF-kB)とp53に対してコンセンサスシーケンスを示す。この遺伝子もTATAボックスを欠いており、複数の転写開始サイトを示唆している。これら全ての要素は、CD157遺伝子がDNA損傷、炎症や感染といった事象によってアップレギュレートされている可能性を示唆し、一方でNF-IL-6やNF-kB結合サイトは関節リウマチ患者のCD157分子発現の増加を説明する可能性を示唆する。
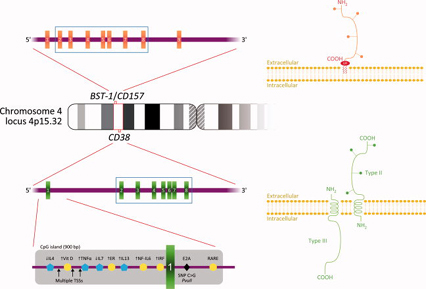
【図1】ヒト染色体4のスキーマ。CD38(とその調節要素)とCD157。
右側は膜のCD38とCD157タンパクの図式的特徴を示している。
CD38とCD157の組織分布
CD38は少なくとも免疫系ではユビキタスであるが、発現レベルは変化すると考えられている。フローサイトメトリー分析によれば、ヒトCD157は末梢血単核細胞(PBMC)のミエロイド(骨髄)細胞によって構成的に発現されている。また、骨膜、血管内皮細胞、濾胞性樹状細胞にも発現する。さらに、皮膚繊維芽細胞、肺や子宮、包皮由来のヒト肥満細胞、とりわけ腹膜中皮細胞といった他の細胞型および組織上に存在する。CD157は近年、マウスの腸管幹細胞機能に及ぼすカロリー制限およびラパマイシンの効果を媒介するパネート細胞に発現することが報告された。
| リンパ | CD38 | CD157 |
| 血液 | T細胞(前駆体活性化) B細胞(前駆体活性化) 骨髄細胞(単球、マクロファージ、樹状細胞) NK細胞 赤血球 血小板 |
好中球 好酸球 好塩基球 単球 マクロファージ Plasmocytoid樹状細胞 |
| 臍帯血 | TおよびBリンパ球、単球 | |
| 骨髄 | 前駆体 形質細胞 |
B細胞前駆体 骨髄前駆体 ストローマ細胞 |
| 胸腺 | 皮質胸腺 | |
| リンパ節 | 胚中心B細胞 | 濾胞性樹状細胞 |
| 脾臓 | 細網細胞(白果肉) | |
| 非リンパ | ||
| 肝臓 | 胎児のB細胞前駆細胞 | |
| 艦船 | 肥満細胞 | |
| 脳 | プルキンエ細胞 培養星状細胞 小脳 |
|
| 目 | 角膜 Gangliar網膜細胞 |
|
| 前立腺 | 上皮細胞 | |
| 腸 | 上皮内リンパ球 粘膜固有層リンパ球 |
刷子縁、絨毛の上皮細胞 パイエル板 cryptopatchesにおける間質細胞 孤立リンパ濾胞 |
| 腹膜 | 中皮細胞 マクロファージ/腹膜滲出 |
|
| 膵臓 | β細胞 | αとβ細胞 |
| 筋肉 | 筋鞘(滑らかで横紋筋) | |
| 骨 | 破骨細胞 | |
| 腎臓 | 糸球体 | 細管の収集 |
受容体としてのCD38
推定上の最初のリガンドは、ヒトTリンパ球が内皮細胞に接着する傾向があるという観察によって同定された。この接着をブロックする実験から、CD31(白血球の接着と遊走に重要なイムノグロブリン[Ig]スーパーファミリーのメンバーであるPECAM-1としても知られる)がCD38に対する非基質性のリガンドであるという結論に至った。CD38/CD31の相互作用は同じシグナル伝達カスケードをトリガーし、作動性モノクローナル抗体を用いて観察される生物学的事象を再現するものであることが後に実証された。CD38とCD31の相互作用は内皮を通した白血球の遊走に非常に重要である。CD38/CD31クロストークは正常もしくは病理学的条件で、T細胞からB細胞、NK、ミエロイド細胞まで多くの異なる環境で広く分析されている。CD38が媒介するシグナルは別のレベルで調整されている:第一レベルは分子の超微細構造に関するもので、単量体、2量体(あるいは多量体)のタイプⅠフォームに存在する。膜ポジションのflip-flop(二者切り替え式)メカニズムが近年提唱されており、CD38のタイプⅢフォームは細胞室内でその触媒部位を表示する。第二レベルは原形質膜内の脂質マイクロドメインにおけるCD38のダイナミックな局在に基づいている。他のタンパクとの横方向の関連は、細胞系統によって異なり、制御の第3レベルを決定している。脂質ラフト局在とシグナル伝達複合体はCD38を通して媒介されるシグナルにとって前提条件である。
受容体としてのCD157
CD157のレセプターとシグナル伝達特性もまた、推定上のリガンドを模倣すべく作動性モノクローナル抗体を用いて調べられた。そうすることで、CD157のライゲーションが焦点接着キナーゼ(*4)(FAK)として同定されている130kDaのタンパク質のチロシンリン酸化(*5)を誘導すること、CD157の関与はヒト骨髄単球性のU937系(*6)におけるCa2+ホメオスタシスを調整し、スーパーオキシド(*7)産生を媒介することが実証されてきた。これらの証拠から、CD157は白血球接着と遊走および血管外遊出の制御におけるキープレイヤーであることが示される。この文脈では、CD157は他の膜貫通分子と横方向の相互作用を確立することによってレセプターとして振る舞い、その構造的な限界(すなわちGPIアンカー分子であるということ)を克服し、シグナルを変更する能力を獲得した。より詳細には、CD157はβ1、β2インテグリンと相互作用し、CD157の抗体誘導性クロスリンクは、これらの複合体が界面活性剤抵抗性膜ドメインへと移動するのを促進する。さらにCD157はインテグリン由来のシグナル伝達ネットワークに効果的に貢献する。それは白血球のtransmigrationに重要であり、チロシンキナーゼレセプターの最適なリン酸化とPI3K(*8)とMAPK(*9)シグナル伝達カスケードの活性を導く。
CD38とCD157の酵素機能
二つのタンパク質の酵素機能が調べられたのは、酵素ADPリボシルサイクレース(ADPRC、軟体動物アメフラシカリフォルニカから生成された)がヒトCD38とprotein sequenceの著しい相同性を示すことが観察された後であった。CD38は多機能酵素であり、ニコチンアミドアデニンジヌクレオチド(NAD+)からサイクリックADP-ribose合成を触媒し、cADPRのADPRへの加水分解を媒介する。酸化条件下ではCD38はニコチンアミドアデニンジヌクレオチドリン酸(NADP+)からニコチン酸アデニンジヌクレオチドリン酸塩(NAADP)の生成を触媒する。cADPR、ADPR、NAADPは細胞質Ca2+流動の調節に関与する異なるレセプターとチャネルに結合し、いくつかの生物学的過程(例えば、リンパ球増殖、心臓と腸の縦筋萎縮、膵臓におけるグルコース誘導性インスリン放出)にとって重要なシグナル伝達経路を活性化する。広範な生理学的機能の調整におけるCD38とその産生物の役割は、CD38ノックアウトマウスにおける様々な障害によって示されている。それらは好中球走化性の障害、不完全なオキシトシン分泌、異常な社会性行動を含んでいる。
CD38の組み替えられた可溶性細胞外ドメインは、CD38自身を含む、いくつかのタンパク質のシステイン残基のADPリボシル化を媒介する。CD38はまたecto-ADP-ribosyltransferase(ARTs)によって変更される。アルギニンADPリボシル化はサイクレース(環化酵素)とヒドラーゼ(加水分解酵素)活性の両者を不活性化し、一方システインADPリボシル化はヒドラーゼ活性の抑制のみにつながる。アルギニンADPリボシル化は細胞内cADPRの減少を引き起こし、それに続いてCa2+流入が減少、続いて活性化Tリンパ球の死を引き起こす。さらに、CD38はほ乳類の細胞では主要なNADグリコヒドラーゼ(NADase)であり、細胞内NAD+レベルを調節している。CD38はこのように、サーチュイン、すなわち加齢や細胞保護、エネルギー代謝に関与する細胞内NAD+依存性脱アセチル化酵素の活性を調節している。
CD157も細胞外NAD+を切断し、cADPRとADPRを生成する。しかしcADPR生成におけるCD157の触媒効率はCD38のそれよりも低い。
CD38またはCD157によって行われるNAD+切断による生成物もまた、細胞外免疫調整として作用する。最近のデータは、これらの生成物がパラクリン(傍分泌)(*10)因子として細胞の外側で働く可能性があることを示している。さらに、触媒反応は細胞のシグナル伝達、DNA修復とアポトーシスに関与するARTとポリADPリボースポリメラーゼ(PARPs)の基質を生成する。
CD38はまた正常または病理学的体液中の可溶性フォームやエキソソームでも発見され、それはB細胞によって分泌される膜小胞であり、細胞内コミュニケーションネットワークの構成要素であると思われる。
CD38と疾患
慢性リンパ性白血病(CLL)
CLLは一般的な成人の白血病で、血中のsmall Bリンパ球(CD19+/ CD5+/ CD23+)、骨髄(BM)、リンパノード(LN)、そしてその他のリンパ組織の蓄積に起因する。CLL細胞におけるCD38の発現上昇は疾患のステージの進行と関連づけられる。CD38は、遊走反応に影響し、血液からリンパ組織への腫瘍細胞の再循環に貢献するケモカインやそのレセプターと連動して働き、インテグリンファミリーに属する特異的な接着分子とも連動して働く。
多発性骨髄腫(MM)
MMは骨髄におけるモノクローナルプラズマ細胞(*11)の蓄積と、高濃度の血漿、尿、溶解性骨変異におけるモノクローナル免疫グロブリン(Ig)によって特徴づけられる悪性腫瘍である。CD38はトップレベルの細胞表面密度でプラズマ細胞(正常でも腫瘍でも)に発現している。またCD38はオキシトシンレベルのkey regulatorであり、オキシトシンはヒト骨芽細胞(*12)によっても放出される。オキシトシンレセプターは骨髄腫細胞と派生ラインでもみられる。CD38は骨芽細胞と破骨細胞に発現し、そこではIL-6放出と骨再吸収の阻害を導くシグナルとなる。
急性前骨髄球性白血病(APL)
APLは急性白血病のユニークなサブタイプであり、前骨髄球の段階で白血球分化の阻害を引き起こす。レチノイン酸(RA)は白血病細胞を成熟顆粒球へと誘導することが出来るため、治療プロトコルに含まれている。正常な顆粒球はCD38-であり、RA処置されたAPL細胞は多くの分子を発現する。白血病細胞におけるCD38の異常発現は肺血管内皮細胞に発現するCD31と相互作用する傾向を強め、炎症性サイトカインの局所的産生、血管内皮細胞のアポトーシスを引き起こし、ついにはレチノイン酸症候群(RAS)を発展させる。
CD157と疾患
卵巣癌
白血球の血管外漏出(*13)は、二次臓器への転移性浸潤と類似した過程である。CD157は中皮細胞に発現し、それは卵巣表面上皮細胞の生物学的特性と発生学的起源を共有するものである。作業仮説はCD157が上皮卵巣癌細胞に発現し、腫瘍細胞と中皮の間の相互作用を導くというものであった。もし確認されれば、CD157は卵巣癌の転移に関与する可能性がある。この仮説は、BST-1/CD157が正常細胞と比較したとき、上皮卵巣癌細胞の一次培養において異なる発現をする遺伝子の中にあるという報告によって支持された。得られた結果は仮説を実証した:実際、CD157は上皮卵巣癌の90%以上で発現しており、上皮卵巣癌細胞と細胞外マトリクスタンパクと中皮細胞の間の相互作用に関連している。これら全ての段階は最終的に、腫瘍細胞と周辺臓器への浸潤をコントロールする。ヒト卵巣癌におけるCD157の高発現は臨床的な病原力に関連づけられ、術後すぐに腫瘍が再発する予測因子としてのCD157の役割を確認するものである。CD157が上皮卵巣癌の進行に機能的に貢献することは、分化プログラムにおいて切り替え可能なことに依存しており、そのために腫瘍細胞が上皮組織構造のルールに打ち勝つことが出来、より間葉系の状態に変えることが出来る。
パーキンソン病
BST-1のSNP、rs11931532、rs12645693、rs4698412、rs4538475は日本のゲノムワイド関連解析(GWA)で散発的な遅発性パーキンソン病のリスクファクターとして同定されている。rs4538475は最も強い関連を示した。rs4698412とパーキンソン病の関連はヨーロッパの母集団でも確認されたが、北ハンチャイニーズでは存在しなかった。北アメリカとヨーロッパの集団で行われたGWAのメタ分析では、BST-1はゲノムワイドの有意水準を超えることが示された。
その他のヒト疾患におけるCD38ファミリーの役割
CLLに対する遺伝子感受性と多型との関連は、全身性エリテマトーデス(SLE)を含む他の疾患でも研究されている。SLEではCC genotypeは感受性を増加させ、GC genotypeは円盤状発疹の進行の保護に寄与する。
CD8+/CD38+ Tリンパ球の割合の高さはHIV感染した成人の疾患の進行を予測する。HIV感染は、明らかに感染によって直接引き起こされる訳ではないが、臨床的にCD38の発現増加によって特徴づけられる。
CD38はSLEと同様、1型および2型糖尿病における自己抗体の標的としても報告されている。
CD38KOマウスの研究から、ASDとの関連も示されている。CD38のSNP、rs6449197、rs3796863、rs1800561がASDと関連づけられている。ASD患者のPBMC(末梢血単核球)由来のリンパ芽球細胞株におけるCD38の発現は、その両親のものより低かった。可能な説明は、細胞表面の発現がASD患者のCD38の酵素の性能にネガティブに影響し、この疾患のCD38/OT軸の機能不全につながるというものである。次のステップは細胞表面のCD38をupregulateするためのレチノイドの役割を調べることである。
新しい作業仮説
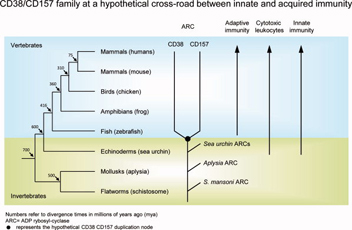
CD38ファミリーの読み取り分析から得られた証拠は初期のCD38/CD157前駆体は自然免疫の構成要素であるということ、免疫細胞表面へのそれらの通り道は適応的免疫への移行と平行して進化したという仮説を導く。我々の仮説は、CD38(CD157はまだこの文脈では考えられていない)が環境に応じた免疫反応の活性化、あるいは抑制を生じる回路の一部であるというものである。
CD38はまた、免疫系を欺くために腫瘍細胞によって採用された複数の方略の中の1つであろう。酵素CD39(エクトヌクレオシド三リン酸ジフォスフォヒドラーゼ1)とCD73(エクト5’ニクレオチダーゼ)はアデノシン(ADO)の生成につながる代謝経路を支配し、ADOがリンパ球によって発現される特異的なレセプターによって取り込まれる時、免疫抑制をするようである。生理学的あるいは病理学的条件で出される内因性シグナルは先天性免疫システムに警鐘を鳴らすのに貢献するかもしれず、抗炎症性サイトカインの産生を伴う。
CD38は近年、マウスモデルで制御性T細胞(Tregs)により発揮される機能と関連づけられている。Foxp3+/CD4+T細胞集団におけるCD38の発現はCD4+制御性Tリンパ球の非常に強力な調整性の特性と関連している。さらにCD38はTregの転写シグネチャーの一部である。CD38KOマウスでは、NAD+がTreg細胞の生存や表現型、機能に影響し、ART2/P2X7システム上での作用はこれらの細胞をin vivoで操作するための新しい方略かもしれないという原理の証明になっている。最近の報告によると、CD8+/CD38high Tリンパ球はin vitroでもin vivoでも強力な免疫抑制能力を持っている。このサブセットは、先天性免疫応答とともに働き、炎症時に免疫恒常性をコントロールする調整能を持っている。
PC-1(CD203aとしても知られる)はnucleotidase pyrophosphatase phosphodiesterase (ENPP1)活性をもつ細胞表面酵素である。我々は近年、CD38/PC-1ネットワークによって導かれる新しい経路の存在を確認した(図3)。それはCD73に基質を与え、その結果異なる器官のADO産生を引き起こす。この経路に関する詳細な知見は、PC-1/CD203aが主に糖尿病に関連した問題に答えるためにヒトの細胞でのみ研究されてきたという事実、そしてADOを解析する技術的な困難とin vitroと生物学的流体で異なる基質によって妨げられてきた。しかし、CD38とCD73の関連が数年前に強調された。
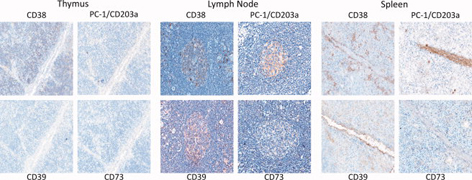
【図3】免疫組織化学によるCD38、PC-1/CD203a、CD39、およびヒト胸腺、
リンパ節および脾臓におけるCD73の分布
この型破りな細胞外酵素ネットワークはどの程度、MMにおける骨髄微少環境(図4)や再発性流産における間葉系幹細胞(MSC)ニッチといった、様々な疾患モデルにおける局所刺激の生成に貢献しうるかは知られていない。先行研究の結果は異なる細胞におけるCD38/PC-1/CD73軸の存在を実証しており、toleranceは恒常性の維持の一部に役割を果たしている。研究は現在、MMとメラノーマ患者のサンプルで、CD38やCD157によって行われる可能性のある免疫回避ストラテジーを決定すべく行われている。これらのサンプルでは、CD39から個別にADOを生成することのできる一連の細胞外酵素がすでに確かめられている。
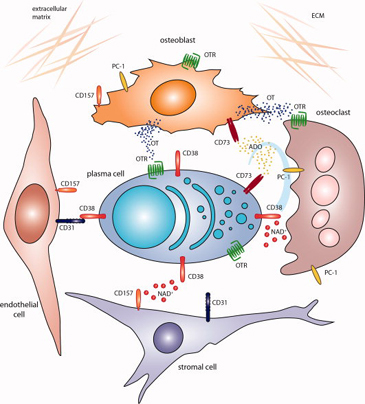
【図4】形質細胞、骨芽細胞、破骨細胞、内皮細胞、および間質の間で行われるクロストークを強調したヒト骨髄の概略モデル
CD38とCD157に関してはいくつかの未回答な問題が残っている。一つはCD38の組織分布であり、リンパ球分化の間の個別の発現から、T細胞とB細胞の生理学的休息状態の間の限られた存在までの範囲に及ぶ。その分子は活性化された細胞により、そして選択的白血病で強く再表現される。活性化マーカーとしてのCD38の概念とは対照的に、最終分化形質細胞(および派生腫瘍)はヒト細胞で最も高い表面密度で発現する。このことはまだ個体発生には解き明かされるべきことが多く存在することを意味している。
さらに、CD38とCD157がectoenzymeであるという事実は、もはや白血球生物学における奇妙な事実と考えられるべきではない;反対に、ヒト細胞表面に発現する分子の4%以上が酵素的特徴を示している。
ヌクレオチドを代謝するectoenzymeはより大きなectoenzymeファミリーのサブグループを構成し、異化作用に関与し、細胞外ヌクレオチドの掃除をする。このプロセスは結果的に、細胞恒常性と代謝に重要な役割を果たす化合物を合成し、単にヌクレオチドのリサイクルに終わらない。最初は、ヌクレオチド代謝ectoenzymeは基質のtrace量のみを含む環境で働き、最終産物は細胞内で一時的に用いられるであろうと考えられていた。この見解は後に修正され、現在では形態学的に基質と最終産物は片面またはその他の形質膜にとどまっていない。
筆者の研究室はこれらの問題に(ⅰ)排他的にヒトモデルに焦点を当てること、(ⅱ)これらの分子の個体発生と系統発生を生理学的手がかりの源として用いること、(ⅲ)疾患からの情報を推論しようとすること、自然そのものによって行われるベストな実験によってこれらの問題に取り組んでいる。
結論として、CD38とCD157は単なる白血球集団の活性マーカーと考えられていたことから、健康もしくは疾患における様々な機能を発揮する分子として認識されるように変わってきた。最後の困難な課題は、これらの表面構造がin vivoでの治療的介入の適切な標的になること、免疫応答のレギュレーターになりうることを実証することである。
用語解説
(*1) 転写開始点の上流約25~37塩基対のところにあるTATAという塩基配列。そしてこのTATAボックスを中心に、転写開始の位置が正しく決定される。
(*2)シトシンの次にグアニンが現れるタイプの2塩基配列(ジヌクレオチド)であるCpGサイトの出現頻度が、ゲノム中で他と比べ高い領域のことである。CpGの「p」の文字は、シトシンとグアニンの間のホスホジエステル結合を表している。哺乳類の遺伝子のうち40%近くが、プロモーター内部もしくはその近傍にCpGアイランドを含んでいるとされる(ヒトの遺伝子のプロモーターでは約70%)。遺伝子コード領域のCpG配列とは異なり、CpGアイランドのCpG配列は遺伝子発現中はメチル化されていない。この事実によって、プロモーター領域のCpG配列のメチル化は遺伝子発現を抑制することが分かった。
(*3)遺伝子重複によって生じた二つの遺伝子はパラログと呼ばれ、一般に機能や構造が異なるタンパク質をコードする。これに対し、異なる生物に存在する相同な機能を持った遺伝子群はオーソログと呼ばれ、種分化の過程で生じたものである。ログ=遺伝子配列。
(*4)インテグリンを介する細胞外マトリックスへの細胞接着に伴う核へのシグナル生成と、細胞移動に伴う焦点接着の形成と分解の制御に中心的役割を果たすタンパク質チロシンキナーゼである。
(*5)蛋白質の細胞内領域チロシン残基に起こる可逆的リン酸基付加反応。高等生物の神経系において、チロシンリン酸化は、様々な神経発生や神経可塑性の過程で、タンパク質の活性や局在、タンパク質間の結合、イオンチャンネルの性質、細胞内情報伝達系等を制御することが知られている。
(*6)単球の振る舞いや分化の研究に用いられる。多くの可溶性刺激に対して成熟と分化をし、成熟マクロファージの形態と特徴に採用される。
(*7)スーパーオキシドは酸素分子の分子軌道の2つのπ*軌道(反結合性のπ軌道)に3つの電子が入った状態の活性酸素種である。ラジカルとしての反応性とアニオンの性質を持つ。スーパーオキシドは酸素分子の一電子還元で生成するが、生体内ではミトコンドリア呼吸鎖電子伝達系、キサンチン酸化酵素、NADH酸化酵素などによって生成される。白血球(好中球)はNADH酸化酵素でスーパーオキシドを生成し殺菌作用に用いている。
(*8)膜の構成成分であるイノシトールリン脂質のイノシトール環3位のリン酸化を媒介する脂質キナーゼであり、ほ乳類ではクラスIA、クラスIB、クラスII、クラスIIIの4つのサブクラスに分類される.このシグナル伝達経路はPI3キナーゼ-Akt経路と呼ばれ、様々な生理作用の発現に関与する。特にインスリンの分泌促進に深く関与することから、新たな糖尿病薬の開発が示唆されている。
(*9)分裂促進因子活性化タンパク質キナーゼ。セリン/スレオニンキナーゼの一つであり、何らかの刺激(酸化ストレス、サイトカインなど)を受けて活性化される。全身の細胞に広く発現しており、様々な細胞の機能発現において重要な働きをしている。
(*10)細胞間におけるシグナル伝達のひとつ。特定の細胞から分泌される物質が、血液中を通らず組織液などを介してその細胞の周辺で局所的な作用を発揮すること。
(*11)形質細胞。抗体産生を行うエフェクターB細胞のなかでもっとも成熟化が進んだ細胞種。
(*12)骨組織において骨形成を行う細胞であり、細胞質は好塩基性を示し、アルカリホスファターゼ活性を有している。核小体は著明。骨芽細胞はアンドロゲンとエストロゲンのレセプターを持っており、アンドロゲンは骨芽細胞の活動性を低下させ、エストロゲンは骨芽細胞を刺激する。
(*13)侵襲の程度が大きい時などには、組織への酸素供給が不足し、嫌気的解糖がすすみ、血中乳酸値が上昇する。傷害領域への血液量が増加し、白血球、とくに好中球や蛋白質に富む血液成分(滲出液)が血管外へ出ていく。このような現象を、「血管透過性が増す」と表現する。この滲出液により、浮腫が起こる。血管外へ出た白血球(主に好中球)は、損傷部位に集まり、異物をとりこんで分解、消化する。この好中球の死骸が「膿」である。

