発達障がい市民広場

- ホーム
- (一般の方へ)発達障がい市民広場
- 最新医学論文29
第29号
最新医学論文29
NMDAレセプター発現抑制マウス:統合失調症より自閉症と合致する?
Mice with reduced NMDA receptor expression: more consistent with autism than schizophrenia?
NMDAレセプターは、中枢神経系を中心に生体内に広く分布し、シナプスの可塑性、記憶や学習などに深く関係すると考えられています。NMDA(N-メチル-D-アスパラギン酸)がアゴニストとして選択的に作用することから分類されました。リガンドであるグルタミン酸の結合を経て、陽イオンを透過する、イオンチャンネル共役型受容体です。透過させる陽イオンには特に選択性はなく、ナトリウムイオン(Na+) やカリウムイオン (K+)の他に、カルシウムイオン(Ca2+)も通すことが知られています。
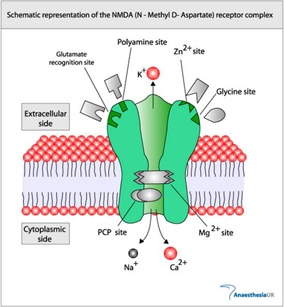
NMDAレセプターはNR1 と NR2 のヘテロ2量体2セットからなる4つのサブユニットで構成されていると考えられています。
この受容体を構成する主要サブユニットの一つ、NR1サブユニットにはグリシンを結合する部位があり、グリシンを結合していないNMDA型受容体は、グルタミン酸刺激によって活性化されません。また通常、細胞外マグネシウムイオン(Mg2+) によってチャネル活性が阻害されているため、脱分極刺激などでMg2+を外してやらないと活動できません。つまり、活動には2種のリガンドとMg2+の除去が必要と言えます。従って、NMDA型受容体は、シナプス前終末からのグルタミン酸による刺激と、シナプス後膜の脱分極が同時に起こった時に活性化され、シナプス後膜からカルシウムイオンの流入を起こす、シナプス前終末とシナプス後膜の神経活動の同時検出器(coincidencedetector)として機能しています。
フェンサイクリジン,ケタミンなどのNMDA型グルタミン酸受容体遮断薬が,統合失調症と区別し難い陽性・陰性症状および認知機能障害を引き起こし,統合失調症と同様に,D2型ドーパミン受容体を強力に遮断する抗精神病薬がこのうちの陽性症状しか改善しないことなどを主な根拠として,統合失調症の病態には,グルタミン酸伝達の低下が関与すると考えられています.NMDA受容体遮断によって脳内ドーパミン伝達が亢進するため,この仮説は,従来のドーパミン伝達過剰仮説とも矛盾しません.
The NMDAR is a specific type of ionotropic glutamate receptor. NMDA is the name of a selective agonist that binds to NMDA receptors but not to other glutamate receptors. Activation of NMDA receptors results in the opening of an ion channel that is nonselective to cations. A property of the NMDA receptor is its voltage-dependent activation, a result of ion channel block by extracellular Mg2+ ions. This allows the flow of Na+ and small amounts of Ca2+ ions into the cell and K+ out of the cell to be voltage-dependent.
The NMDA receptor forms a heterotetramer between two NR1 and two NR2 subunits; two obligatory NR1 subunits and two regionally localized NR2 subunits.
The NMDA receptor cation channel is blocked by Mg2+ at resting membrane potential. To unblock the channel, the postsynaptic cell must be depolarized. The NMDA receptor therefore functions as a molecular coincidence detector. Its ion channel only opens when the following two conditions are met simultaneously: glutamate is bound to the receptor, and the postsynaptic cell is depolarized (which removes the Mg2+ blocking the channel).
The NMDA receptor antagonist, such as Phencyclidine or Ketamine, causes positive / negative symptoms and cognitive dysfunction which are difficult to distinguish from schizophrenia. Antipsychotic drugs that strongly block dopamine D2 receptors improve only positive symptoms, so downregulation of glutamate signaling is associated with pathophysiology of schizophrenia. Dopamin signaling is enhanced by block of NMDA receptor, so it does not contradict with dopamine excess hypothesis.
このように、NMDAレセプターの機能低下と統合失調症が関連づけられてきましたが、最近、自閉症との関連が言われるようになってきています。NMDAレセプターのサブユニットの一つであるNR1のノックアウトマウスは、社会的相互作用やメイティング、自発的活動の減少と、sensorimotor gatingの障害、自傷行為、認知的柔軟性の欠如などを示すとされています。このことは、NR1ノックアウトマウスが自閉症のような、陰性症状や感覚過敏などを示す障害のモデルなのではないか、ということを示唆しています。
Reduced NMDA-receptor mediated glutamatergic signaling has been strongly linked to the pathophysiology of schizophrenia
NR1neo-/- mice, which were generated to have constitutive -85% downregulation of the obligate NMDA-NR1 subunit, have extensive behavioral abnormalities, including reduced social interactions and mating, locomotor hyperactivity, deficits in sensorimotor gating, self-injury and cognitive inflexibility.
Such findings suggested that NR1neo-/- mice might be a more robust model for disorders characterized by negative symptoms and sensory hypersensitivity, such as autism
実験と結果について、まず社会性の障害についてですが、(b)はメスのマウスに対して、NR1ノックアウトマウスはワイルドタイプに比べ、interaction timeが短く、また(c)は3チャンバーでのオスマウスに対するsniffingをみていますが、新しいマウスに対するsniffing timeも少ないという結果でした。

In Fig.1(b), male NR1neo-/- mice initiated significantly less social contact, as measured by total interaction time to female mouse. In addition, in Fig.1(c), sociability to a same-sex, unfamiliar WT mouse was measured with a standard three-chambered social approach/avoidance paradigm. In this task, NR1neo-/- mice again showed significantly reduced sociability.
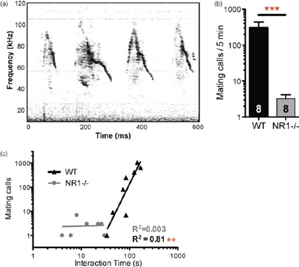
次に、コミュニケーション障害について、Fig.2(a)はワイルドタイプのpre-mating callを示しており、Matingの際には約70kHzのpre-mating callと、約40kHzのmating callをするとされています。しかし(b)に示されるように、NR1ノックアウトマウスはそのような発声が有意に少なく、また(c)に見られるように、ワイルドタイプではUSVとinteraction timeに有意な正の相関が見られたのに対し、NR1ノックアウトマウスでは相関がみられませんでした。
Fig.2(a) shows 70 kHz ‘pre-mating’ vocalizations and 40 kHz ‘mating’ USVs recorded from a WT mouse.NR1neo-/-mice emit significantly fewer ultrasonic pre-mating calls than do WT littermates. The number of calls emitted by WT males was highly correlated with the amount of social interaction time, indicating the social significance of USVs. This association did not hold for NR1-transgenic mice, indicating a lack of appropriate social communication function.
反復行動や興味の限局、自傷、変化への抵抗は自閉症の中核症状ですが、NR1変異マウスでは、テイルサスペンションテストにおいてhandwringingというステレオタイプ的行動をとることが多く、またグルーミングのしすぎによる自傷がWTよりも多くみられました。

During tail suspension, NR1-transgenic mice exhibited a similar forepaw clasping/wringing behavior at a significantly greater rate than WT littermates. Likewise, NR1neo-/-mice were found to have significantly more skin lesions caused by self-injurious, over-grooming behavior.

自閉症に合併する行動表現型について、知的障害や様々な活動レベルの障害、睡眠障害などが言われていますが、NR1変異マウスは、図では示されていませんが、空間的ワーキングメモリーを測定したTメイズにおいて認知障害を示しました。また、明暗サイクルで120時間観察したところ、NR1変異マウスは活動性の増加を示し、それは本来活動しないはずの明るいときに最も現れていました。
In this paper, they assessed cognitive function using a discrete T-maze paradigm, which measures spatial working memory. NR1-transgenic mice showed significantly reduced alternation, consistent with a deficit in cognitive function. They monitored the activity patterns in NR1neo-/-mice across the light-dark cycle over a 120-h period. A main effect of genotype indicated increased LMA(locomotor activity) in NR1-transgenic mice, an effect that was most apparent during the light cycle.
自閉症と関連した中間表現型について、聴覚刺激に対する感覚過敏やPPIの低下が関連づけられています。つまり、小さい音を聞かせた後に大きい音を聞かせると、ふつうは次第にあまり驚かなくなるのですが、いつまでも音に対する驚愕反応が続くということになります。最初の小さい音、つまりプレパルスは感覚入力のゲートを閉めると考えられており、PPIの低下はsensorimotor gatingの障害と考えられています。
Fig.5のaはNR1変異マウスが音に対する驚愕反応が大きいことを示し、bはPPIの低下を示しています。
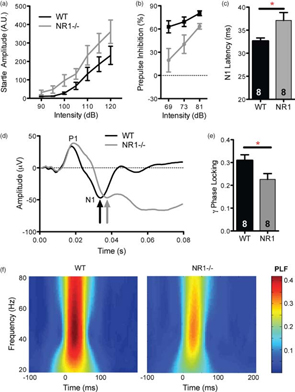
自閉症者やその1親等の親族で、聴覚ERP(事象関連電位)の異常がみられ、聴覚処理の遅延がみられると報告されており、ASDにおけるコミュニケーション障害を示しているとされています。聴覚誘発反応は、P1ピークはマウスはP20、ヒトではP50、N1ピークはマウスでN40、ヒトではN100でよく似ています。Fig.5(c)のように、変異マウスでは、N1コンポーネントの潜時に10-15%のdelayが見られ、自閉症児でみられる結果と一致していました。また、P1ピークとN1ピークの振幅には差がないことも一致していました。
また、最近の研究から、自閉症におけるneural synchronyの異常が報告されています。30-80Hzの高周波、ガンマオシレーションが感覚のencodingや選択的注意、記憶といった認知・感覚機能を媒介していることが示されています。つまり、脳の異なる領域における神経同期発火は認知処理と関連していると言われ、大脳皮質では、錐体細胞と介在ニューロンの相互連絡が密になされており、介在ニューロンから錐体細胞への抑制性入力がガンマ帯域反応の生成に大きな役割を果たしているとされています。自閉症における一過性の聴覚誘発性ガンマバンドの反応の減少は、そのような知覚機能の異常を反映すると思われています。Fig.5の(e)と(f)はNR1KOマウスでも、位相同期性の早期の聴覚ガンマ帯域反応が有意に減少していることを示しています。
Autism is characterized by hypersensitivity to auditory stimuli coupled with reduced PPI of the acoustic startle response. NR1neo-/-mice showed enhanced startle amplitudes, indicative of increased sensory-motor reactivity. Conversely, transgenic mice exhibited a significant reduction in PPI.
Clinical studies measuring auditory ERPs have shown that early auditory encoding processes are abnormal in autism. Recent work has reported delayed profiles of auditory processing in subjects with autism as well as in unaffected relatives to a lesser degree. Auditory-evoked responses are highly analogous between mice and humans, with corresponding P1 (mouse P20, human P50) and N1 (mouse N40, human N100) peaks. Transgenic mice showed a significant, 10-15% delay in the latency of the N1 component of the auditory-evoked response, identical to that observed in clinical studies of autistic children. The amplitudes of P1 and N1 peaks did not differ between groups, consistent with the clinical phenotype in ASD.
Recent work has shown abnormal neural synchrony in autism. In particular, high-frequency, gamma oscillations have been shown to mediate a host of cognitive and sensory functions, including sensory encoding, selective attention and memory. Several studies have identified reduced transient auditory-evoked gamma-band responses in autism, thought to reflect abnormal cognitive and perceptual functioning. Likewise, the phase-locked early auditory gamma-band response was significantly reduced in NR1neo-/-mice.
NMDAレセプターの機能低下は社会性とコミュニケーション障害、反復行動や自傷行為、PPIの障害と関連すること、聴覚機能、探索能力、発声、視覚・嗅覚機能、運動協調性はすべてインタクトであることが示されました。
聴覚誘発反応の早期成分の潜時の遅延はASDとその1親等の親族で報告されており、言語障害と関連づけられていますが、統合失調症ではみられません。反対に、聴覚事象関連電位のピーク振幅の減少は統合失調症でよくみられますが、ASDではみられません。聴覚誘発性のガンマシンクロニーは両方の障害で報告されており、同じ神経の異常を反映しているのかもしれません。
共通の表現型は、いずれもNMDARのシグナリングの減少によって起こる介在ニューロンの機能不全あるいは興奮・抑制のバランスの崩壊に由来するのかもしれません。
This study has shown that constitutive NMDAR hypofunction in mice is associated with deficits in social and communicative functioning as well as elevated repetitive and self-injurious behaviors, deficits in PPI.This study has also shown that auditory function, exploratory ability and the capacity to vocalize, visual and olfactory function, motor coordination are all intact.
Delayed latencies in the early components of the auditory-evoked response (as observed here) have been reported in ASD patients and their first-degree unaffected relatives and have been associated with language impairment in autism. In contrast, latencies of these peaks are not different in schizophrenia. Reduced peak amplitudes of the auditory ERP (not observed here) are well replicated in schizophrenia. Subjects with ASD, however, do not show reduced amplitudes of these ERP peaks.
Similar deficits in auditory-evoked gamma synchrony have been reported across both disorders and may reflect shared neural abnormalities. Common phenotypic deficits may stem from shared circuit insults, such as interneuron dysfunction or disrupted excitatory/inhibitory balance, both of which can be caused by reduced NMDAR signaling.
自閉症はグルタミン酸の機能亢進であるという仮説もありますが、これは高機能自閉症のマウスモデルでグルタミン酸レベルの増加があることに基づいており、NMDAレセプターの過剰発現は学習や記憶の能力を高め、サヴァンのような能力を説明できるかもしれません。NMDAレセプターのシグナル伝達も逆U型のプロファイルを示し、両方向への逸脱が行動の機能を悪化させるのかもしれません。このことが、自閉症者で重度の知的障害をもつ者から正常、あるいは高い認知機能をもつ者まで均一でないことの説明になるかもしれません。今後はNMDAレセプターの過剰発現の影響を調べる必要があるとされています。
また、統合失調症と自閉症を分ける重要な特性が、その発症年齢であるにもかかわらず、adult mouseのみを用いていますが、今後は若いマウスにも焦点を当てる必要があるとされています。
In contrast to the premise of this study, there has been some suggestion that autism is characterized by glutamatergic hyperfunction. This hypothesis is based on elevated blood levels of glutamate in high-functioning autism coupled with some mouse models showing enhanced long-term potentiation and/or elevated NMDAR levels. Overexpression of NMDARs has been shown to enhance some forms of learning and memory in mice and could account for the savant-like abilities reported in some individuals with autism. Like many neural pathways, it is likely that optimal NMDAR signaling follows an ‘inverted U’ profile, where deviations in either direction from a homeostatic set point would cause deteriorated behavioral function. This could also account for the significant degree of phenotypic heterogeneity observed in individuals with autism, some with severe intellectual disability and others with normal, or even elevated, cognitive function. Future work should investigate the effect of NMDAR overexpression
A second potential limitation focuses on the age of the mice employed in this study. Only adults were used despite the fact that the age of disease onset is an important characteristic that separates autism from schizophrenia. Future work will focus on juvenile NR1neo-/- and WT mice to determine the onset of phenotypic and endophenotypic deficits.

